Néovascularisation/angiogenèse
![]()
La néovascularisation consiste en la formation de nouveaux réseaux microvasculaires. In vivo, ce processus se déroule principalement par le biais de l’angiogenèse, autrement dit la croissance de nouveaux vaisseaux à partir de vaisseaux existants. La néovascularisation/l’angiogenèse jouant un rôle crucial dans de nombreuses thérapies et pathologies, elle est activement étudiée dans une multitude de domaines, parmi lesquels l’ingénierie tissulaire et la médecine régénérative, la biologie vasculaire et l’oncobiologie. En fonction de l’application, il existe de nombreux modèles pour le développement/l’administration de médicaments, la caractérisation de maladies et les traitements par cellules souches. Des outils permettant d’évaluer la formation de nouveaux vaisseaux, de préférence à l’aide de méthodes non invasives et non destructives, sont nécessaires. Le système d’imagerie de contraste speckle laser PeriCam PSI permet de suivre les modifications de la perfusion microvasculaire au fil du temps. Des études ont montré que des augmentations de la perfusion sont associées à la formation de vaisseaux sanguins plus fonctionnels. Le système PeriCam PSI a été utilisé dans plusieurs de ces modèles.
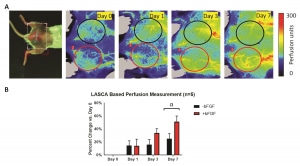
(A) Photo de vue dorsale et images longitudinales de perfusion PSI d’une souris porteuse de deux implants d’échafaudage à base de fibrine, avec et sans facteur de croissance angiogénique. Les ROI ont été choisies en fonction de l’emplacement physique des implants. (B) La quantification de la modification de la perfusion par rapport au jour 0, sur la base d’une analyse des ROI des images de perfusion PSI, montre une augmentation globale de la perfusion au fil du temps. Le changement le plus notable dans la perfusion a été observé le jour 7, avec des échafaudages +bFGF tendant vers une perfusion plus importante que les échafaudages -bFGF 1-2.
Figure fournie par le Dr Mario Fabiilli, co-auteur de l’étude LED-Based Photoacoustic Imaging for Monitoring Angiogenesis in Fibrin Scaffolds, auteurs : Yunhao Zhu, Xiaofang Lu, Xiaoxiao Dong, et al. Publication : Tissue Engineering Part C: Methods
Éditeur : Mary Ann Liebert, Inc. Date : 1er septembre 2019
Présentation
Le système PeriCam PSI a prouvé son utilité à de nombreux égards dans le domaine de la recherche sur la néovascularisation et l’angiogenèse, et plus particulièrement dans le cadre de la recherche de thérapies pro-angiogéniques pour l’artériopathie périphérique (AP) et la cicatrisation dans des modèles animaux précliniques. Pour l’AP, une ischémie est induite par voie chirurgicale dans l’extrémité inférieure et confirmée au moyen du système PeriCam PSI, et le processus dynamique de rétablissement de la perfusion peut être suivi au fil du temps. De même, des plaies cutanées sont créées et le PeriCam PSI est utilisé pour suivre leur cicatrisation normale. Dans les deux modèles, le système PeriCam PSI offre aux chercheurs la possibilité d’assurer un suivi longitudinal des mêmes sujets, ce qui permet de réduire le nombre d’animaux nécessaires pour une étude et ainsi de gagner du temps et de l’argent.
Un autre domaine est l’étude du cancer dans l’essai sur CAM et les modèles tumoraux sous-cutanés, ainsi que le développement d’agents thérapeutiques anti-angiogéniques. Le système PeriCam PSI peut être utilisé pour suivre la perfusion dans les tumeurs à mesure qu’elles progressent et évaluer l’efficacité des agents thérapeutiques destinés à les combattre.
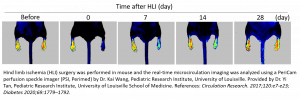
Ischémie des membres postérieurs
Le modèle murin de préparation d’ischémie des membres postérieurs est fréquemment utilisé dans l’étude de l’AP. Il consiste en la ligature unilatérale de l’artère fémorale et son excision pour induire une ischémie aiguë permettant l’évaluation de la régénération vasculaire, de l’angiogenèse et de l’artériogenèse par un ensemble de stratégies telles que l’administration de facteur de croissance et la thérapie cellulaire. Il sert aussi à évaluer les effets pro-angiogéniques des agents thérapeutiques 3-12 ou du rétablissement naturel chez les animaux sains 13 versus malades (diabétiques) 14-16, jeunes versus âgés 17 et de type sauvage versus knock-out 18-20.
Le système d’imagerie de contraste speckle laser PeriCam PSI sert à confirmer l’ischémie après chirurgie en mesurant la diminution de la perfusion sanguine dans la microcirculation (60-70 %), ainsi qu’à monitorer longitudinalement l’efficacité de la stratégie de traitement. En général, chaque animal est suivi jusqu’à un mois après la chirurgie ou le traitement à l’aide de la PSI pour documenter l’augmentation graduelle de la perfusion sanguine à la suite de la revascularisation ; cela permet au chercheur de réduire le nombre d’animaux nécessaires à l’étude et ainsi de gagner du temps et de l’argent.
Essai sur membrane chorioallantoïde de poulet (CAM)
Au cours du développement de l’embryon du poulet, la membrane chorioallantoïde (CAM) se forme par fusion des mésodermes de l’allantoïde et du chorion. Il s’agit d’une membrane extra-embryonnaire fortement vascularisée et non innervée, ce qui en fait un substrat idéal pour l’étude de l’angiogenèse et de la croissance tumorale. Un œuf de poule fertilisé est incubé durant quatre à huit jours, quand une ouverture est créée dans la coquille pour observer l’embryon en formation et les vaisseaux sanguins.
Dans les essais en angiogenèse, plusieurs biomolécules et médicaments sont parfois administrés par voie topique et étudiés pour leur efficacité angiogénique. Des échafaudages en biomatériau peuvent également être implantés et monitorés pour surveiller l’envahissement vasculaire, afin d’évaluer une stratégie d’ingénierie tissulaire.
Dans les modèles de cancer, plusieurs types de cellules cancéreuses peuvent être greffées dans la CAM pour étudier la croissance tumorale. Cela offre un modèle relativement simple pour étudier la formation de différentes tumeurs cancéreuses tout en permettant de tester de nouveaux médicaments et des stratégies de traitement personnalisées. Le modèle CAM est hautement reproductible, rentable et ne nécessite pas d’approbation par les comités d’éthique, comme c’est le cas pour de nombreux autres modèles animaux in vivo. En outre, le modèle CAM présente une immunodéficience naturelle qui le rend idéal pour la transplantation cellulaire ; le système fermé prolonge la demi-vie de nombreuses molécules expérimentales, ce qui en réduit la quantité nécessaire pour l’étude.
Le système d’imagerie de contraste speckle laser PeriCam PSI peut servir à mesurer les variations de la perfusion sanguine dans le cadre d’un essai d’angiogenèse et détecter les différences d’efficacité de divers produits pro-angiogéniques. Il peut aussi servir à monitorer la formation de vaisseaux sanguins fonctionnels intra-tumoraux 25 et à évaluer l’efficacité d’agents anti-angiogéniques pour le traitement du cancer.
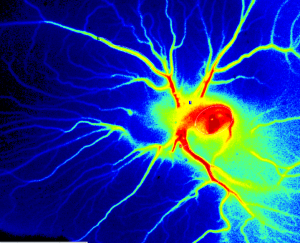
Image PSI Z de la perfusion dans le cadre de l’essai CAM 6 jours après la fertilisation.
Tumeur sous-cutanée
La croissance et la métastatisation des tumeurs dépendent du développement de vaisseaux sanguins et d’une microcirculation efficace. En l’absence d’angiogenèse, un petit foyer de cellules tumorales ne peut pas se développer au niveau d’un site secondaire. Dans la mesure où l’angiogenèse joue un rôle central dans la croissance tumorale, la progression, l’envahissement et la formation de métastases, son inhibition constitue une stratégie thérapeutique potentielle pour certains cancers.
Le modèle tumoral sous-cutané est le système le plus couramment utilisé pour l’évaluation in vivo de nouveaux candidats-médicaments anticancéreux. Généralement au moyen de souches animales immunodéficientes, des cellules cancéreuses cultivées sont implantées sous la peau des animaux afin d’induire la formation d’une tumeur en 2 semaines environ. Une multitude de lignées cellulaires cancéreuses humaines et murines ont été adaptées pour se développer chez un hôte rongeur et donc permettre l’évaluation d’agents thérapeutiques dans le modèle tumoral pertinent. Les chercheurs suivent la croissance et la progression tumorales, et réalisent souvent un test de densité microvasculaire tumorale pour évaluer l’efficacité de leur stratégie de traitement. Le système PeriCam PSI peut servir à monitorer l’évolution de la perfusion sanguine dans les tumeurs sous-cutanées, ainsi qu’à évaluer l’efficacité des thérapies anti-angiogéniques pour le traitement du cancer.
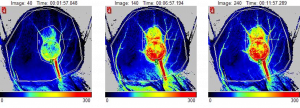
Images de la perfusion d’une oreille de souris avec tumeur sous-cutanée au jour 14. Les images montrent une augmentation de la perfusion sanguine tumorale en réaction à une épreuve de chauffage.
References:
1. LED-Based Photoacoustic Imaging for Monitoring Angiogenesis in Fibrin Scaffolds. Yunhao Zhu, Xiaofang Lu, Xiaoxiao Dong, Jie Yuan, Mario L. Fabiilli, and Xueding Wang. 9, September 2019, Tissue Engineering Part C: Methods, Vol. 25, pp. 523-531.
2. Controlled release of basic fibroblast growth factor for angiogenesis using acoustically-responsive scaffolds. Alexander Moncion, Melissa Lin, Eric G. O’Neill, Renny T. Franceschi, Oliver D. Kripfgans, Andrew J. Putnam, Mario L. Fabiilli. 2017, Biomaterials, Vol. 140, pp. 26-36.
3. MiR-15b-5p Regulates Collateral Artery Formation by Targeting AKT3 (Protein Kinase B-3). Ling-Ping Zhu, Ji-Peng Zhou, Jia-Xiong Zhang, Jun-Yao Wang, Zhen-Yu Wang, Miao Pan, Ling-. May 2017, Arteriosclerosis, Thrombosis, and Vascular Biology, Vol. 37, pp. 957-968.
4. Precise and long-term tracking of adipose-derived stem cells and their regenerative capacity via superb bright and stable organic nanodots. Dan Ding, Duo Mao, Kai Li, Xiaomin Wang, Wei Qin, Rongrong Liu, David Shunzhong Chiam, Nikodem Tomczak, Zhimou Yang, Ben Zhong Tang, Deling Kong, Bin Liu. 12, 2014, ACS Nano, Vol. 8, pp. 12620-12631.
5. Extracellular Matrix Hydrogel Promotes Tissue Remodeling, Arteriogenesis, and Perfusion in a Rat Hindlimb Ischemia Model. Jessica L. Ungerleider, Todd D. Johnson, Melissa J. Hernandez, Dean I. Elhag, Rebecca L. Braden, Monika Dzieciatkowska, Kent G. Osborn, Kirk C. Hansen, Ehtisham Mahmud and Karen L. Christman. 1-2, 2016, JACC: Basic to Translational Science, Vol. 1, pp. 32-44.
6. Engineering an Injectable Muscle-Specific Microenvironment for Improved Cell Delivery Using a Nanofibrous Extracellular Matrix Hydrogel. Nikhil Rao, Gillie Agmon, Matthew T. Tierney, Jessica L. Ungerleider, Rebecca L. Braden, Alessandra Sacco, Karen L. Christman. 2017, ACS Nano, Vol. 11, pp. 3851-3859.
7. Marrow-isolated adult multilineage inducible cells embedded within a biologically-inspired construct promote recovery in a mouse model of peripheral vascular disease. Cristina Grau-Monge, Gaëtan J-R Delcroix, Andrea Bonnin-Marquez, Mike Valdes, Ead Lewis Mazen Awadallah, Daniel F Quevedo, Maxime R Armour, Ramon B Montero, Paul C Schiller, Fotios M Andreopoulos and Gianluca D’Ippolito. 1, 2017, Biomedical Materials, Vol. 12, p. 015024.
8. Natural compound bavachalcone promotes the differentiation of endothelial progenitor cells and neovascularization through the RORα-erythropoietin-AMPK axis. Shuang Ling, Rong-Zhen Ni, Yunyun Yuan, Yan-Qi Dang, Qian-Mei Zhou, Shuang Liang, Fujiang Guo, Wei Feng, Yuanyuan Chen, Katsumi Ikeda, Yukio Yamori, and Jin-Wen Xu. 49, 2017, Oncotarget, Vol. 8, pp. 86188-86205.
9. Topical tissue nano-transfection mediates non-viral stroma reprogramming and rescue. Daniel Gallego-Perez, Durba Pal, Subhadip Ghatak, VeysiMalkoc, Natalia Higuita-Castro, Surya Gnyawali, Lingqian Chang, Wei-Ching Liao, Junfeng Shi, Mithun Sinha, Kanhaiya Singh, Erin teen, Alec Sunyecz, Richard Stewart, JordanMoore, Thomas Ziebro, Robert. 2017, Nature Nanotechnology, Vol. 12, pp. 974-979.
10. In vivo efficacy of endothelial growth medium stimulated mesenchymal stem cells derived from patients with critical limb ischemia. Rida Al-Rifai, Philippe Nguyen, Nicole Bouland, Christine Terryn, Lukshe Kanagaratnam, Gaël Poitevin, Caroline François, Catherine Boisson-Vidal, Marie-Antoinette Sevestre & Claire Tournois. 17, 2019, Journal of Translational Medicine, Vol. 9, p. 261.
11. NFAT5 promotes arteriogenesis via MCP‐1‐dependent monocyte recruitment. Zhang, Xing‐Chi Lin Miao Pan Ling‐Ping Zhu Quan Sun Zheng‐Shi Zhou Chuan‐Chang Li Guo‐Gang. 2, 2020, Journal of Cellular and Molecular Medicine, Vol. 24.
12. MicroRNA-146a Regulates Perfusion Recovery in Response to Arterial Occlusion via Arteriogenesis. Heuslein Joshua L., McDonnell Stephanie P., Song Ji, Annex Brian H., Price Richard J. 2018, Frontiers in Bioengineering and Biotechnology, Vol. 6, p. 1.
13. Denervation in Femoral Artery-Ligated Hindlimbs Diminishes Ischemic Recovery Primarily via Impaired Arteriogenesis. Yinghuan Cen, Junfeng Liu, Yuansen Qin, Ruiming Liu, Huijin Wang, Yu Zhou, Shenming Wang, Zuojun Hu. 5, 2016, PLOS One, Vol. 11, p. e0154941.
14. Elevating CXCR7 Improves Angiogenic Function of EPCs via Akt/GSK-3β/Fyn-Mediated Nrf2 Activation in Diabetic Limb Ischemia. Xiaozhen Dai, Xiaoqing Yan, Jun Zeng, Jing Chen, Yuehui Wang, Jun Chen, Yan Li, Michelle T Barati, Kupper A Wintergerst, Kejian Pan, Matthew A Nystoriak, Daniel J Conklin, Gregg Rokosh, Paul N Epstein, Xiaokun Li, Yi Tan. 2017, Circulation Research, Vol. 120, pp. e7-e23.
15. Sitagliptin-mediated preservation of endothelial progenitor cell function via augmenting autophagy enhances ischaemic angiogenesis in diabetes. Dai, X., Zeng, J., Yan, X., Lin, Q., Wang, K., Chen, J., Shen, F., Gu, X., Wang, Y., Chen, J., Pan, K., Cai, L., Wintergerst, K. A. and Tan, Y. 1, 2018, Journal of Cellular and Molecular Medicine, Vol. 22, pp. 89-100.
16. Endothelial Overexpression of Metallothionein Prevents Diabetes-Induced Impairment in Ischemia Angiogenesis Through Preservation of HIF-1α/SDF-1/VEGF Signaling in Endothelial Progenitor Cells. Kai Wang, Xiaozhen Dai, Junhong He, Xiaoqing Yan, Chengkui Yang, Xia Fan, Shiyue Sun, Jing Chen, Jianxiang Xu, Zhongbin Deng, Jiawei Fan, Xiaohuan Yuan, Hairong Liu, Edward C. Carlson, Feixia Shen, Kupper A. Wintergerst, Daniel J. Conklin, Paul N. Epstein. 8, August 2020, Diabetes, Vol. 69, pp. 1779-1792.
17. DNA Methyltransferase 1–Dependent DNA Hypermethylation Constrains Arteriogenesis by Augmenting Shear Stress Set Point. Joshua L. Heuslein, Catherine M. Gorick, Ji Song, Richard J. Price. 12, 2017, Journal of the American Heart Association, Vol. 6.
18. Loss of Endothelial CXCR7 Impairs Vascular Homeostasis and Cardiac Remodeling After Myocardial Infarction. Huifeng Hao, PhD, et al. 2017, Circulation, Vol. 135, pp. 1253-1264.
19. Vascular growth responses to chronic arterial occlusion are unaffected by myeloid specific focal adhesion kinase (FAK) deletion. Joshua L. Heuslein, Kelsey P. Murrell, Ryan J. Leiphart, Ryan A. Llewellyn, Joshua K. Meisner & Richard J. Price. 2016, Scientific Reports, Vol. 6, p. 27029.
20. Despite Normal Arteriogenic and Angiogenic Responses, Hindlimb Perfusion Recovery and Necrotic and Fibro-Adipose Tissue Clearance Are Impaired in MMP9 Deficient Mice. Meisner JK, Annex BH, Price RJ. 6, 2015, Journal of Vascular Surgery, Vol. 61, pp. 1583–1594.
21. Cutaneous Epithelial to Mesenchymal Transition Activator ZEB1 Regulates Wound Angiogenesis and Closure in a Glycemic Status–Dependent Manner. Singh, Kanhaiya and Sinha, Mithun and Pal, Durba and Tabasum, Saba and Gnyawali, Surya C. and Khona, Dolly and Sarkar, Subendu and Mohanty, Sujit K. and Soto-Gonzalez, Fidel and Khanna, Savita and Roy, Sashwati and Sen, Chandan K. 11, 2019, Diabetes, Vol. 68, pp. 2175-2190.
22. Correction of MFG-E8 Resolves Inflammation and Promotes Cutaneous Wound Healing in Diabetes. A. Das, S. Ghatak, M. Sinha, S. Chaffee, Noha S. Ahmed, N. L. Parinandi, E. S. Wohleb, J. F. Sheridan, C. K. Sen, and S. Roy. 12, 2016, The Journal of Immunology, Vol. 196, pp. 5089-5100.
23. Circulating Exosomal miR-20b-5p Inhibition Restores Wnt9b Signaling and Reverses Diabetes-Associated Impaired Wound Healing. Yuan Xiong, Lang Chen, Chenchen Yan, Wu Zhou, Yori Endo, Jing Liu, Liangcong Hu,Yiqiang Hu, Bobin Mi and Guohui Liu. 3, 2020, Small, Vol. 16, p. 1904044.
24. Saliva Exosomes-Derived UBE2O Promotes Angiogenesis in Cutaneous Wounds by Targeting SMAD6. Bobin Mi, Lang Chen, Yuan Xiong, Chenchen Yan, Hang Xue, Adriana C. Panay, Jing Liu, Liangcong Hu, Yiqiang Hu, Yun Sun, Faqi Cao, Wu Zhou, Guohui Liu. 18, 2020, Journal of Nanobiotechnology, Vol. 6, p. 68.
25. Laser speckle contrast analysis (LASCA) technology for the semiquantitative measurement of angiogenesis in in-ovo-tumor-model. Eric Pion, Claudia Asam, Anna-Lena Feder, Oliver Felthaus, Paul I. Heidekrueger,Lukas Prantl, Silke Haerteis, Thiha Aung. 2020, Microvascular Research, Vol. 133, p. 104072.
Pour plus d’informations, merci de remplir le formulaire.
Avertissement : il est possible que certains produits sur le site Web de Perimed ne possèdent pas d’autorisation de vente sur tous les marchés.



